|
|
|
|
|
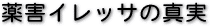 |
|
|
|
|
 |
|
 |
1989年 弁護士登録 (東京弁護士会所属・41期)
東京都立川市内で24名の弁護士とともに法律事務所を開業。・・一般民事・刑事事件の他、東京HIV訴訟(副団長)、ハンセン病国家賠償請求訴訟、薬害イレッサ訴訟(副団長)
などを手がける。薬害防止のためのNGO 「薬害オンブズパースン会議」 事務局長 (1997年〜現在)、「薬害対策弁護士連絡会」事務局長 (2005年〜2007年)、
厚生労働省「薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討会」委員 (2008年〜2010年) などを務める。
他、講演活動なども行っている。
著書・ (弁護団編) 「薬害エイズ裁判史(全5巻)」 「ハンセン病違憲国賠裁判全史・全9巻」 他。 |
|
|
|
|
|
|
|
|
本年5月、薬害イレッサ訴訟について、東京高等裁判所に続き、大阪高等裁判所は、原告全面敗訴の判決を言い渡しました。両訴訟とも提訴は2004年です。被害者は提訴から8年を超えてなお最高裁での闘いを続けなければならなくなったのです。
実は、この訴訟については、昨年1月7日に、東京・大阪両裁判所から同時に和解勧告が出され、全面解決につながるチャンスがありました。
裁判所の和解勧告所見には,最後の命綱として副作用が少ないと言われたイレッサを使用し,副作用である間質性肺炎によって苦しんで死亡した患者と遺族の深刻な被害を十分に理解すると記載されていました。そして、裁判所は、1月28日までに、和解協議の席につくか否かの回答を求めたのです。
原告側は早々に和解協議の席に着くと回答をしました。1月19日には、厚労省の元審議官土井脩氏が、被害は防げたはずで、国と企業は和解協議に応じるべきだとする見解を新聞上で明らかにしました。これは大きな波紋を呼び、和解協議開始への期待が膨らみました。しかし、1月24日から翌日にかけて、国立がんセンターの他、日本臨床腫瘍学会他の関係医学会が和解協議に応じるべきではないとする見解を公表し、同じ日にアストラゼネカ社が和解協議を拒否、和解期限には国も拒否したのです。
後に、この一連の医学会等の見解は、厚労省が依頼したものであり、中には厚生労働省が声明の下書きまで提供していたものもがあることが分かりました。
この種の事件は、和解協議に応じるか否かという局面では政治判断です。そこで、厚労省の官僚は、関係医学会等に対して、和解に消極的な見解の公表を依頼し、その見解を国会議員や閣僚の説得に使い、政府に和解拒否を促したのです。この「下書き提供問題」は、国会質問でも取り上げられ、厚労省は調査チームを発足させざるを得なくなりました。しかし、調査チームが公表した報告書は、真相の究明にはほど遠いものでした。そればかりか、「自省の利益」を守るために局議で決めて「メディア対策」として声明を依頼することは「正当な業務」の範囲であるとし、ただ、下書きまで提供したことは「過剰なサービス」だったというまとめをしたのです。 |
|
|
|
|
|
|
|
|
いずれにしても、訴訟は、企業と国が和解を拒否したため判決となり、昨年2月25日に大阪地裁、3月23日に東京地裁で言い渡されました。判決の判断は分かれ、大阪地裁は企業の責任のみを認め、東京地裁は、企業と国の責任を認めました。
しかし、国の責任を否定した大阪地裁も、国の対応に問題がなかったとしたわけではありません。イレッサの初版添付文書については警告が不十分で製造物責任法の「欠陥」があると指摘し、国の添付文書に関する行政指導には問題があったと指摘しているのです。ただ、最高裁判所の判例で、国が規制の権限を行使しなかったことについて賠償責任を問われるのは、裁量を著しく逸脱したといえる場合であるとされていることに照らして、問題はあるが裁量逸脱というレベルには達していないという理由で国の責任を否定したに過ぎなかったのです。国は法律論に助けられてかろうじて法的責任を免れただけなのです。
そのため、大阪判決の後、当時の福山副官房長官は、官邸内で大阪訴訟の原告と面談し、3月に東京の判決が出た後は、改めて東京の原告の方々との面談の機会を設けると述べたのでした。
しかし、3月11日、あの東日本大震災と原発事故が発生しました。新聞紙面は震災と原発一色、原告は、3月23日に東京地裁で、悲願の国と企業の責任を認めた画期的判決を手に入れ、本来であればこれをもとに政治解決を迫るはずでしたが、それが許されるような環境ではなかったのです。
そして,事件は控訴審に移りました。しかし、東京高裁は、わずか2回の期日で審理を終え、それから20日という極めて異例のスピードで昨年11月に原告逆転敗訴の判決を下し、本年5月には、大阪の高等裁判所も原告の請求をすべて棄却したのです。 |
|
|
|
|
|
|
|
|
ところで、私が事務局長をしている薬害防止を目的とするNGO、薬害オンブズパースン会議では、厚労省に対し、「下書き提供問題」についての調査チームの報告書のもととなった関係者への聴取票やメールなどの公開を求めて情報公開請求をしました。しかし、開示をうけた100枚近い書類はそのほとんどが黒く塗られていました(コピーをすると読むところはほとんどないのに、トナーばかりがなくなります)。
そこで、やむなく国に対して情報公開請求訴訟を提起したのです。この情報公開請求訴訟は、東京地裁で続いています。その過程で、国が一部の資料の墨塗りを解除しました。国が保有している情報は公開が原則ですので、裁判所から黒く塗る理由を説明せよと言われ、どうこじつけても説明できなかったのだと思います。一部公開された書類中には、厚生労働省から関係者への働きかけの状況について、職員がチェックするために作成した「アタックリスト」なるものがありました。また、「裁判所の所見に従うならば、あらゆる未知の危険まで明らかにならないと抗がん剤のような新薬の承認ができなくなることを意味しています。」「今後リスクのある医薬品の承認はますます困難になります。」と記載して、和解に消極的な見解の公表を促した厚労省発信のメールもありました。
もちろん和解に応じると新薬の承認ができなくなるなどということはありません。そもそも和解勧告は未知の副作用のことは一言も触れていないのです。裁判所は、承認前に分かっていた副作用に関する情報を患者に提供するべきだった、それがされていないのだから被害者を救済しなさいと言っているのです。しかも、裁判所が求めたのは、和解協議の席につくというだけのことであり、内容は協議に入ってからの交渉次第です。それを、厚労省や医学会が、ここまでして和解協議の開始を阻止しようとするのは何故なのか。そこまでしなければならない薬害イレッサ事件とは何なのか。薬害イレッサ事件の真実を知ってほしいと思います。 |
|
|
|
|
|
|
|
|
まず、基本的なことを確認しておきましょう。イレッサは,2002年7月22日,世界で初めて日本で承認された抗がん剤です。製造販売はイギリスに本社を置くアストラゼネカ社の日本法人。適応は、手術不能または再発の非小細胞肺がんで、通院で服用できる錠剤でした。
「分子標的薬」と言われる(このネーミングは学術的なものではありません)新しい作用機序の抗がん剤でしたが、承認申請から5ヶ月余という異例のスピードで承認され、8月30日には保険適用となりました。当時、新薬の承認には申請から約1年近くかかるのが通例で、しかも抗がん剤の承認は常に海外の後塵を拝していましたから、異例ずくめのことでした。
実は、イレッサが承認された頃、日本は、それまで医薬品の審査を担当していた国の組織である審査センターを、独立行政法人にするという構想をもっていました(実際、この年の12月に独法化法案が国会を通過し、翌年の4月に現在の独立行政法人医療機器総合機構−PMDAが発足しています)。独法化に伴って審査手数料も大幅に値上するが、その代わり審査期間は短縮されるというのが国の説明であり、イレッサは、きたるべき迅速審査の先駆けと位置づけられていました。
しかも、イレッサは,承認前から,製薬企業による副作用が少ない「夢の新薬」という宣伝が行きわたり、医療現場や患者の期待を集める中で市販されたのです。 |
|
|
|
|
|
|
|
|
ところが、承認されるや、直後から副作用である間質性肺炎やそれによる死亡報告が相次ぎ、承認から3ヶ月で緊急安全性情報が発出され,添付文書が改訂され警告欄が設けられました。
間質性肺炎による死亡は窒息死と同様ですから大変苦しいのです。東京の原告近澤さんのお嬢さんは、苦しさのあまり横になることもできず座ったまま亡くなりました。この最後のむごさはいつまでもご遺族を苦しめて続けています。
一体どれほどの人がこの間質性肺炎によって亡くなったのでしょうか。2012年3月までにイレッサの副作用である間質性肺炎によって死亡した患者は厚労省の発表で847人ですが(私たちはこの全員が薬害被害者であると言っているわけではありません)、このうち,162人は承認3か月目に緊急安全性情報が出されるまでの死亡者、承認から1年間の死亡者は294人です。これに対し,2010年の死亡報告数は16人、2011年の死亡者は23人です。このことは、イレッサの被害が適切な警告など安全対策をとれば回避できたことを示しています。 (右の表参照) |
 |
 |
 |
 |
| ■間質性肺炎による死亡・・初期に集中■ |
| 2002年 |
180人 |
(7月〜12月の半年) |
| 2003年 |
202人 |
|
| 2004年 |
175人 |
・・・累計557人 |
| 2005年 |
80人 |
|
| 2006年 |
52人 |
|
| 2007年 |
38人 |
|
| 2008年 |
44人 |
|
| 2009年 |
34人 |
|
| 2010年 |
16人 |
|
| 2011年 |
23人 |
|
| 2012年 |
3人 |
(1月〜3月) |
| 2012年3月末までに847人の死亡例報告 |
|
 |
 |
 |
 |
|
|
|
|
|
|
|
|
|
|
では、イレッサが致死的な間質性肺炎を生じさせる危険性をもっていることは承認前は、わからなかったのでしょうか?
そうではない、分かっていた。ここが肝心です。企業や国は、承認前から分かっていた危険性を医療現場に適切に伝えなかったのです。これまでの薬害事件で繰り返されてきたことがイレッサでも繰り返されてしまったのです。
承認前のイレッサに関する副作用の情報源は、国内臨床試験、国外臨床試験、拡大治験プログラム(Expanded Access Program、略してEAP:製薬企業が承認前に医薬品を提供する米国の制度)です。「治験」(承認申請のための臨床試験)の参加者は667人、EAPでは約2万人を超えるが使用していたと言われています(この中には日本人で米国制度を利用した方があり、その数は296人です)。
日本には「治験副作用報告制度」があり、治験の対象となっている医薬品によって生じた副作用は、治験外の使用で出たものであっても報告するシステムがとられています。そこで、イレッサについては、治験だけでなく、治験以外の海外臨床試験や、EAPで生じた副作用の情報も国や企業に届いていました(但し、EAPで出た副作用については報告率が低く、弁護団の計算では、イレッサの場合7分の1以下です)。
このうち、まず重要なのは国内臨床試験です。国内臨床試験には103人の日本人が参加し、このうち3人が間質性肺炎を発症していました(この3人について、アストラゼネカ社は当初イレッサの副作用ではないとしていました。しかし、承認審査をした国はイレッサの副作用と認定しています)。3人のうち2人は主治医が「死亡のおそれ」のある症例として報告しており、残る1名も重症です。特に1名は人工呼吸管理が必要な状態でした。医薬品で起きる本来の副作用の発生率を出すには多くの分母が必要で、統計学では3%の確率で起きることを検出するには100人ではなく、300人が必要とされています(3倍の法則)。ですから、たかだか100名余の臨床試験で生じ
たこの結果は、イレッサが引き起こす間質性肺炎が深刻なものであることの貴重なシグナルだったのです。
国や企業は、死亡症例はなかった(イレッサは余命の限られたがん患者が使用しますから3人とも死亡していますが、死亡の原因はイレッサの間質性肺炎ではなく、病勢進行等によるという意味)ということを強調しています。しかし、先に述べた人工呼吸管理までした症例は死亡例といってよく、仮にそうでないとしても、少なくともイレッサの副作用である間質性肺炎が致死的なものであることは、3例の間質性肺炎が十分に示していたのです。
また、海外の臨床試験やEAPからは、間質性肺炎による死亡者がでています。この中には日本人も含まれています。 <右の参考資料の1をご覧ください。>
これは東京地裁と大阪高裁が認めたイレッサの副作用患者を表にしたものです。左に承認申請から市販に至る経過を記載しています。裁判所が認めた数は、原告が主張した数よりずっと控えめですが、それでも承認申請前から承認直前まで次々と間質性肺炎の副作用が報告がされていたことが分かります。
東京地裁は23例の間質性肺炎の発症と、このうち13例が死亡例であることを認め、大阪高等裁判所でさえも19例の間質性肺炎の発症と、このうち11例が死亡していたという認定をしているのです。
大阪高裁の認定でも致死性は十分に示されています。現在は、イレッサの間質性肺炎の発症率が他の抗がん剤の3倍で、発症するとその約半分が死亡するということが分かっています。承認前の段階でここまでのことは分からなかったとしても、イレッサが決して副作用の少ない夢の新薬などではなく、致死的な間質性肺炎を発生させる危険性をもつ抗がん剤であることは国と企業には分かっていたのです。 |
|
|
|
|
|
原判決及び東京地裁判決が共通して認定する
間質性肺炎の副作用症例報告経過表 |
 |
 |
| ※資料をクリック拡大してご覧下さい |
|
|
|
|
|
|
|
|
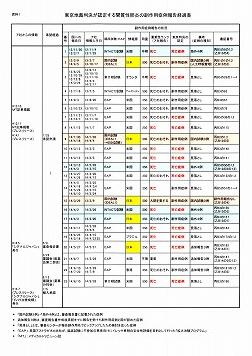
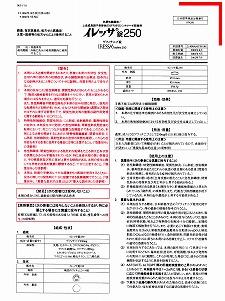
しかし、添付文書による間質性肺炎に関する警告は不十分でした。右の参考資料2、イレッサの添付文書の比較をみてください。現在の添付文書では赤枠の警告欄で間質性肺炎についての注意喚起がありますが、初版の添付文書には、警告欄の記載はありません(添付文書の記載要領、つまり記載基準は当時も今も同じです)。
間質性肺炎は、2枚目裏の「重大な副作用」欄の4番目に小さい文字で「間質性肺炎(頻度不明)間質性肺炎があらわれることがあるので、観察を十分に行い、異常がみとめられた場合には、投与を中止し適切な措置を行うこと」と記載されるのみでした。目立たちません。「致死的」ということも明記されていません。これで添付の一覧表に示された致死的肺炎発症のリスクとこの記載にはギャップがあります。
しかも、重大な副作用欄内で、間質性肺炎より前の方に記載されていた下痢や皮膚・肝機能の障害は、製薬企業の承認 |
|
|
|
|
| イレッサ添付文書・現在 |
イレッサ添付文書・初版 |
 |
 |
 |
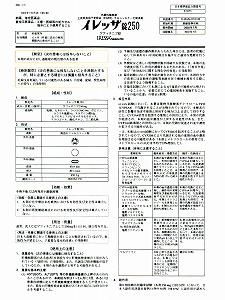 |
| ※資料をクリック拡大してご覧下さい |
|
|
|
前宣伝物、厚生労働省の薬事食品衛生審議会などで、「臨床上あまり問題とならない」と説明されていたものばかりです。
当時の添付文書の記載要領は、「致死的または重篤且つ非可逆的な副作用が発現する場合」には、添付文書冒頭の警告欄に赤字で大きなポイントで明記し、注意を喚起することを求めていました。
実は、国も訴訟で「平成14年7月当時、イレッサによる、承認用量で間質性肺炎が発症する可能性は否定できず、従来の抗がん剤による間質性肺炎と同様に症例によっては致死的となる可能性があることは否定できない」状況にあったことは認めているのです。
従って、記載要領を当てはめると、警告欄に記載すべき場合に該当しました。しかし、記載されなかったのです。結局、警告欄における警告がなされたのは、承認から3か月後の2002年10月15日の緊急安全性情報とこれに続いた添付文書の改訂によってでした。
これに対して、国やアストラゼネカ社は、「重大な副作用」欄は、患者によっては死亡のおそれがある場合にも記載する欄であるから、初版の添付文書の記載でも、ここに記載されていれば、医師なら症例によっては致死的な間質性肺炎の発症の可能性があることは分かるはずとかと主張しました。そして、東京高裁や大阪高裁の判決もこの主張を支持したのです。「抗がん剤を使う医師なら初版の添付文書程度の記載でも分かるはず」というのです。
しかし、果たしてそうでしょうか。承認直後から大量に発生した間質性肺炎の副作用による死亡は、承認から3か月後に緊急安全性情報が発出され、警告欄に間質性肺炎の記載をする添付文書改訂が行われた後、明らかに減っているのです。この事実は、何より雄弁に、改訂前の初版添付文書が、医師への注意喚起として不十分だったことを物語っています。
東京地裁判決は次のように指摘しています。「医師の1〜2人が読み誤ったというのであればともかく、多くの医師が読みあやまったと考えられるときには、医師に対する情報提供の方法が不十分であったとみるべきである。」
まさにそのとおりなのです。 |
|
|
|
|
|
|
|
|
加えて、重要なことは、既に述べたように、アストラゼネカ社が、承認前から、イレッサは副作用の少ない新しい作用機序の抗がん剤であるという宣伝を行っていたということです。
この宣伝の特徴は、分子のみを攻撃するので、抗がん剤でよく見られる骨髄抑制等の副作用は少ないという点を強調する一方、間質性肺炎のリスクについては全く触れないという点にありました。プレスリリースやオピニオンリーダーを使った対談記事など実に様々な方法で行われ、医師だけでなく、患者やマスコミでさえターゲットしたという点も特徴的でした。そして、アストラゼネカ社のプレスリリースを鵜呑みにしてマスメディアは、イレッサが副作用の少ない画期的な新薬であるという報道を繰り返し行い、被害の拡大に一役買う結果となったのです。
こうして承認の頃には、医療現場には、副作用が少ない夢の新薬であるという期待が広がり、間質性肺炎に対する警戒感はありませんでした。
既に延べたように致死的な間質性肺炎は、添付文書の記載要領に当てはめると警告すべき場合に該当しますが、加えて、副作用が少ないとする宣伝や承認当時の医療現場の状況を踏まえると、はっきりと警告欄で致死的な間質性肺炎に対する注意喚起をすることが、一層強く求められていたのです。 |
|
|
|
|
|
|
|
|
イレッサには、有効性の問題もあります。
このことを理解していただくには、まず腫瘍縮小と延命効果の関係について理解していただくことが必要です。がん患者さんにとっては余命が伸びること、少なくとも生活の質(QOL)が改善することが重要です。しかし、延命効果があるかどうかを臨床試験(第Ⅲ相臨床試験といいます)で確認するには時間がかかります。そこで、新薬を待つ患者さんの利益を考えて、有効性評価の仮の指標として腫瘍縮小効果を位置づけ、これがあれば承認し、延命効果は、市販後の臨床試験で証明することを「承認条件」とするというやり方がイレッサの承認当時は行われていました(現在は、承認前に延命効果まで証明することを求めるのが原則です)。なぜ腫瘍の縮小は仮の指標かというと、腫瘍が縮小しても、延命やQOLの改善が認められるとは限らないことが多くの研究で示されているからです。
そして、イレッサも、市販後の臨床試験で延命効果を証明することを承認条件として承認されたのです。しかし、2008年、承認条件であった第Ⅲ相臨床試験(試験名V1532)で、延命効果の証明に失敗しました。
これに先だって行われた複数の大規模な国際的な第Ⅲ相臨床試験(試験名INTACT、ISEL、SWOG2003)の結果が2004年から相次いで公表されましたが、そこでも延命効果を証明できませんでした。
そこで、日本に遅れて2003年にイレッサを承認していた米国では、2005年6月に新規患者への投与を禁じる措置をとりました。そして、2011年10月には、アストラゼネカ社は承認申請を取り下げました。
EUでも、2005年に承認申請が取り下げられ、2008年に再申請に対し承認が与えられましたが、適応は、「成人のEGFR遺伝子変異陽性の局所進行または転移を有する非小細胞肺がん」という極めて狭い範囲に限定されました。
これに対し、日本だけは、「手術不能・再発非小細胞肺癌」という広い適応を認めて、イレッサを使い続けてきたのです。2011年11月、日本でもようやく適応をEGFR遺伝子変異陽性の患者に限定しましたが、このEGFR遺伝子変異陽性患者はEUでは1割、日本では3割と言われています。裏返せばイレッサを服用した7割の方にはイレッサは初めから有効性はなかったということです。遺伝子変異陰性患者でありながらイレッサを使用して間質性肺炎で死亡された方は、効くはずもない薬で死亡したということになり、少なくともこのグループの方々にとって、間質性肺炎を副作用と呼んでいいのかという根本的な疑問が生じるのです。 |
|
|
|
|
|
|
|
|
もう一つ薬害イレッサ事件について知っていただきたいことは、専門家との経済的な関係を強めて医薬品の開発から宣伝、使用ガイドラインの策定、訴訟対応に至るまでを有利に進めるという、現代の典型的なビッグ・ファーマのマーケティング戦略がみごとに現れているということです。
薬害イレッサ訴訟では、アストラゼネカ社や国が6人の専門家証人を申請しました。ところが、このうち、アストラゼネカ社と利益相反関係のない者は,厚生労働省の安全対策課の元課長の平山佳伸証人のみでした。他の証人はイレッサの開発もしくはその副作用である間質性肺炎の研究など,本件薬剤に直接関連する事柄にかかわる経済的関係があります。例えば、西條長宏証人は、当時国立がんセンター東病院の副院長で、いわゆるオピニオンリーダーと言われる人でしたが、イレッサの承認前から、副作用が少ないとする宣伝等に関与し、アストラゼネカ社の講演も多数引き受け、臨床試験にも関与していています。福岡正博証人もイレッサの開発段階から関与しています。西日本胸部腫瘍臨床研究機構(WJTOG)というNPO法人を中心となって設立し、2004年にこのNPO法人の会長を務めるようになってから、このNPOにはアストラゼネカ社から毎年2000万の寄付を受け続けました。工藤翔二証人には、イレッサが承認された2002年から2007年に個人として360万の報酬を受領し、所属する大学の講座に毎年100万の奨学寄付金を受けました。
また、厚生労働省は、海外の大規模臨床試験で相次いで延命効果の証明に失敗して、EUや米国がイレッサの市場性を失わせる措置をとり始め、日本はどうするのかが注目される中で、日本肺がん学会に「使用ガイドライン」の作成を指示し、学会が作成したガイドラインに基づく添付文書改訂を企業に指示してイレッサの使用を継続したのですが、このガイドライン作成委員会のほとんどの委員がアストラゼネカ社との利益相反関係を有していました。
この問題は国会でも取り上げられ、厚生労働大臣は、日本肺がん学会に利益相反関係を明らかにさせるということを約束しましたが、学会が具体的な利益相反関係を明らかにすることはありませんでした。
そして、既にみたように和解勧告に対する否定的な声明を出した学会の多くでこれらの関係者が重要なポストをしめていたのです。
医薬品の開発から宣伝、そして問題が起きた後は使用ガイドラインの作成、法廷での証言、和解への消極見解の表明と全課程をカバーみごとまでの連携です。薬害イレッサ事件は、産官学の極めて深刻な癒着を告発しているのです。 |
|
|
|
|
|
|
|
|
では、薬害訴訟としての特色はどこにあるのでしょうか。
イレッサ訴訟は、国に対しては国家賠償責任に基づき、企業に対しては、製造物責任法と不法行為法に基づいて賠償請求をしています。国家賠償法と不法行為法に基づく請求という点は過去の薬害集団訴訟と同じです。
しかし、製造物責任法に基づく賠償請求は、薬害集団訴訟としては初めてのものです。製造物責任法は、1994年に消費者保護の目的で制定された法律です。それまで不法行為訴訟では「過失」が要件とされ立証が困難でした。そこで、過失ではなく「欠陥」を要件とし、欠陥=「通常有すべき安全性」が欠けていることを証明すればよいとしたのです。最近の薬害訴訟といえば薬害肝炎事件ですが、被害発生は、製造物責任法制定前だったので、この法律は使えなかったのです。
そして、薬害イレッサ訴訟では、既に述べた添付文書や広告宣伝上の問題を「指示警告上の欠陥(表示上の欠陥)」、承認された適応では延命効果が証明されていない一方、致死的な間質性肺炎が発生しているという点を「設計上の欠陥」として主張しています(医薬品の有効性はあくまで承認された適応症との関係で評価されるのです)。
これに対し、東京地裁は添付文書に関する指示警告上の欠陥、添付文書に関する国の規制権限不行使を認め、大阪地裁は添付文書に関する指示警告上の欠陥は認めたが、国の規制権限不行使は違法とまではいえないとして否定し、東京と大阪の両高裁は、国と企業の責任を一切認めませんでした。これは述べたとおりです。ちなみに設計上の欠陥はどの裁判所も認めませんでした。
法的な問題に深入りするのは控えたいと思いますが、1つだけ指摘しておきます。それは東京高裁判決と大阪高裁判決は、過去の薬害訴訟の判例に反するということであり、製造物責任法制定の意義を失わせる不当な判決であるということです。これを最高裁で取り消させなければ、将来に禍根を残します。
既に述べたように、薬害イレッサ事件では、大阪高裁でさえ、イレッサによる19例の間質性肺炎のうち11例が死亡していたと認めるほどに致死的な副作用の報告が集積されていました。薬事法に基づく制度は、「因果関係が否定できない」ものを副作用と定義し、集積された副作用全体から当該医薬品の危険性を評価し、安全対策をとることを求めています。因果関係があることの証明を求めていたのでは安全対策が後手に回るからです。
ところが、東京高裁判決は、集められた個々の副作用について因果関係が「否定できない」だけではなく「ある」とまで言えるものに基づいて安全対策をとったかどうかを問題とすればよいのだと述べています。大阪高裁判決もこの東京高裁判決と実質は同様で、個々の副作用と医薬品の因果関係についての濃淡を問題とし因果関係が濃いものに基づいて安全対策をとればよいとする考え方を示しています。そして大阪高裁は、自ら認めた19例の間質性肺炎について、主治医によって11例の因果関係が否定できない副作用死亡が報告されているが、このうち因果関係がはっきりしているのは1例だけだから、初版の程度の警告でいいのだと言っているのです。大阪高裁がみているのは症例カードといわれる極めて限定された副作用の報告カードです。このカードの限られた情報から個々の症例の関係の濃淡を論じること自体がナンセンスなのですが、その点を捨象しても、疑いの段階で対策をとるという予防原則的な考え方に基づく薬事法の体系や実務と真っ向から対立するのです。
製造物責任法は、過去の薬害訴訟の判例が不法行為法の過失を抽象的にとらえて過失を認められやすくしてきた流れをさらに一歩進めるために制定されたものです。その製造物責任法の「欠陥」の判断が、不法行為法の「過失」より認められにくいということがあっていいのでしょうか。過去の薬害訴訟の到達点や製造物責任法制定の意義を失わせる両高裁判決は最高裁で取り消されなければなりません。 |
|
|
|
|
|
|
|
|
ところで、薬害イレッサ事件については、そもそも「薬害なのですか。」と質問されることがあります。答えは、「もちろん薬害です。」
こう聞いてくる方は、過去の薬害事件では、多くの場合、訴訟が提起される頃にはその薬は販売停止になるなどして市場から姿を消していたのに、イレッサの場合、薬は市場にあり、がん患者さんによっては効いている人がいるという話しを聞くからだと思います。
確かにイレッサの場合、中にはこの薬によって腫瘍が縮小したり、医師から宣告された余命により長く生きられたりという方がいます。 しかし、だからといって薬害ではないということではないのです。薬を市場から回収しなければならない場合だけが薬害ではないのです。
国や企業が分かっていたのに医薬品に関する危険性情報を十分に提供しなかった。そのために、十分な情報が提供されていれば使わなかったはずの患者さんが被害を受けた場合、それは紛れもない薬害なのです。
このとき、注意しなければならないのは、時間軸。つまり、いつの話をしているのかということです。昨年、フジテレビで薬害イレッサ事件を薬害と呼ぶことに疑問を投げかける特集が組まれましたが、致死的な間質性肺炎に対する充分な情報の提供を受け、充分な体制のもとでイレッサを使用している今の患者さんの話と、承認直後に副作用の少ない画期的新薬という情報が氾濫し添付文書の警告も不十分だった中でイレッサを使った患者さんの話を混同するという致命的な誤りを犯していました。
確かに,がん患者さんの中には、リスクが高くてもチャレンジしたいという方はいるでしょう。余命が限られているとなればなおさらでしょう。しかし,薬害イレッサ訴訟の原告となった方々を初めとする多くの患者さんは、危険性を承知してチャレンジしたのではなく、イレッサを副作用の少ない画期的な新薬であると信じて服用したのです。薬害イレッサ訴訟の原告は、自己決定権を行使する機会さえ与えられなかった方々なのです。
製薬企業や国は、この点をあえて混乱させるようなふるまいをしています。イレッサが薬害として問われるようになると、迅速な承認の流れに棹さすことになるとか、画期的新薬を承認しにくくなるとかと言って、がん患者の方々を不安に陥ら、がん患者と薬害イレッサ訴訟の原告を対立関係に置こうとさえしています。「弱みにつけこむ」というのはこういうことを言うのだと思います。冒頭でご紹介した厚労省発信のメールも同じ土俵にあります。 |
|
|
|
|
|
|
|
|
日本の薬害訴訟は、被害救済だけではなく、薬害防止をはじめさまざまな政策的な課題を訴訟の目的に掲げてきました。
薬害イレッサ訴訟は、被害救済、薬害再発防止、抗がん剤被害救済制度の創設などを求めています。
そして、この訴訟は何より「がん患者の命の重さを問う訴訟」なのです。肺がんは治療困難な疾患です。そして,イレッサは余命が限られた肺がん患者が使用する薬剤です。しかし,余命が限られた患者が使用する医薬品だからといって,分かっていた副作用を十分に警告しないでよいはずはありません。有効性と安全性の検討が疎かでよいはずもありません。
余命が限られた患者だからこそ,残された時間をどのように過ごすのか、薬の有効性や危険性を十分に知って選ぶことの意味は重いのではないでしょうか。藁にもすがる思いでよい薬を待っている、だからこそ、それにつけ込むようなことがあってはならないのです。こういうやり方が通用すると企業と国に思わせていけない。余命が限られている患者の遺族なら訴訟を起こすことはないだろう、そんな見方を裏切って、原告の方々は、人としての尊厳をかけて、世界有数のビッグ・ファーマに、困難な闘いを挑み続けています。問われているのは「正義」だと思います。
是非、支援していただきたいと思います。 |
|
|
|
|
|
2012年10月 |
|
|
|
|